
INFORMACIÓN PARA LA PRESCRIPCIÓN
Página 2/4 ..... [1 - 2 - 3 - 4]
El Estudio RA-III evaluó a 247 pacientes que tenían enfermedad activa a pesar de recibir MTX durante al menos 6 meses antes del reclutamiento del estudio. Los pacientes recibieron 400 mg de CIMZIA cada cuatro semanas durante 24 semanas sin una dosis de ataque previa. Los pacientes fueron evaluados por los signos y los síntomas de RA usando la ACR20 en la Semana 24.
El Estudio RA-IV (monoterapia) evaluó a 220 pacientes que habían fracasado con el uso de al menos una DMARD antes de recibir CIMZIA. Los pacientes fueron tratados con 400 mg de CIMZIA o placebo cada cuatro semanas durante 24 semanas. Los pacientes fueron evaluados por los signos y los síntomas de RA activa usando ACR20 en la Semana 24.
Respuesta Clínica
El porcentaje de pacientes tratados con CIMZIA que lograron respuestas ACR20, 50 y 70 en los Estudios RA-I y RA-IV se muestra en la Tabla 3. Los pacientes tratados con CIMZIA tuvieron índices de respuesta ACR20, 50 y 70 mayores a los 6 meses en comparación con los pacientes tratados con placebo. Los resultados en el estudio RA-II (619 pacientes) fueron similares a los resultados en RA-I en la Semana 24. Los resultados en el estudio RA-III (247 pacientes) fueron similares a los observados en el estudio RA-IV. A lo largo del Estudio RA-I de un año, el 13% de los pacientes tratados con CIMZIA lograron una repuesta clínica importante, definida como el logro de repuesta ACR20 en un período continuo de 6 meses, comparado con el 1% de los pacientes tratados con placebo.Tabla 3: Respuestas ACR en los Estudios RA-I y RA-IV (porcentaje de Pacientes)
| Respuesta | Estudio RA-I Combinación con Metotrexato (24 y 52 semanas) |
Estudio RA-IV Monoterapia (24 semanas) |
||||
| Placebo + MTX N=199 |
CIMZIA(a)200 mg + MTX cada 2 semanas N=393 |
CIMZIA(a)200 mg + MTX- Placebo + MTX (IC del 95%)(d) |
Placebo N=109 |
CIMZIA(b) 400 mg cada 4 semanas N=111 |
CIMZIA(b) 400 mg- Placebo (IC del 95%) (d) |
|
| ACR20 Semana 24 Semana 52 |
14% 13% |
59% 53% |
45% (38%, 52%) 40% (33%, 47%) |
9% N/A |
46% N/A |
36% (25%, 47%) |
| ACR50 Semana 24 Semana 52 |
8% 8% |
37% 38% |
30% (24%, 36%) 30% (24%, 37%) |
4% N/A |
23% N/A |
19% (10%, 28%) |
| ACR70 Semana 24 Semana 52 |
3% 4% |
21% 21% |
18% (14%, 23%) 18% (13%, 22%) |
0% N/A |
6% N/A |
6% (1%, 10%) |
| Respuesta Clínica Principal |
1% | 13% | 12% 8% 15% | |||
(a) CIMZIA administrado cada 2 semanas precedido por una dosis de ataque de 400 mg en las Semanas 0, 2 y 4
(b) CIMZIA administrado cada 4 semanas no procedido por un régimen de dosis de ataque
(c) La respuesta clínica principal se define como el logro de la respuesta ACR70 a lo largo de un períod o continuo de 6 meses
(d) Intervalos de Confianza del 95% construidos usando la aproximación de una muestra grande con la Distribución Normal.
Tabla 4: Componentes de la Respuesta ACR en los Estudios RA-I y RA-IV
| Parámetro+ | Estudio RA-I | Estudio RA-IV | ||||||
| Placebo + MTX N=199 |
CIMZIA(a)200 mg + MTX cada 2 semanas N=393 |
Placebo + MTX N=109 |
CIMZIA(b)400 400 mg cada 4 semanas Monoterapia N=111 |
|||||
| Admisión | Semana 24 | Admisión | Semana 24 | Admisión | Semana 24 | Admisión | Semana 24 | |
| Cantidad de articulaciones sensibles (0-68) | 28 | 27 | 29 | 9 | 28 (12,5) | 24 (15,4) | 30 (13,7) | 16 (15,8) |
| Cantidad de articulaciones inflamadas (0-66) | 20 | 19 | 20 | 4 | 20 (9,3) | 16 (12,5) | 21 (10,1) | 12 (11,2) |
| 3 (1,0) | 4 (0,7) | 56 | 65 | 25 | 4 (0,6) | 3 (1,1) | ||
| Evaluación general del paciente (c) | 67 | 60 | 64 | 32 | 3 (0,8) | 3 (1,0) | 3 (0,8) | 3 (1,0) |
| dolor (c)(d) | 65 | 60 | 65 | 32 | 55 (20,8) | 60 (26,7) | 58 (21,9) | 39 (29,6) |
| Índice de incapacidad (HAQ)(e) | 1,75 | 1,63 | 1,75 | 1,00 | 1,55 (0,65) | 1,62 (0,68) | 1,43 (0,63) | 1,04 (0,74) |
| CRP (mg/L) | 16,0 | 14,0 | 16,0 | 4,0 | 11,3 | 13,5 | 11,6 | 6,4 |
(a) CIMZIA administrado cada 2 semanas precedido por una dosis de ataque de 400 mg en las Semanas 0, 2 y 4
(b) CIMZIA administrado cada 4 semanas no procedido por un régimen de dosis de ataque
(c) Estudio RA-I – Escala Análoga Visual: 0 = mejor, 100 = peor. Estudio RA-IV- Escala de Cinco Puntos: 1 = mejor, 5 = peor
(d) Evaluación del Paciente de Dolor por Artritis. Escala Análoga Visual: 0 = mejor, 100 = peor
(e) Cuestionario de Evaluación de Salud de Índice de Incapacidad; 0 = mejor, 3 = peor, mide la capacidad del paciente para realizar lo siguiente: vestirse/arreglarse, levantarse, comer, caminar, extenderse, agarrar, higienizarse y mantener la actividad cotidiana. Todos los valores corresponden a la última observación obtenida.
*Para el Estudio RA-I, se presenta el promedio. Para el Estudio RA-IV, se presenta la media (DE) excepto para CRP que presenta la media geométrica. El porcentaje de pacientes que lograron las respuestas ACR20 por visita para el Estudio RA-I se muestra en la Figura 1. Entre los pacientes que recibieron CIMZIA, las respuestas clínicas se observaron en algunos pacientes dentro de una a dos semanas después de la iniciación de la terapia.
Figura 1 Estudio RA-I Respuesta ACR20 a lo largo de 52 Semanas*
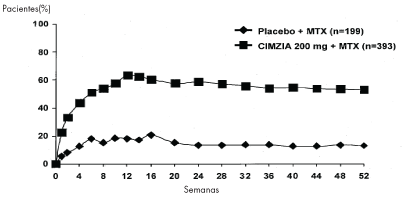
*Los mismos pacientes pueden no haber respondido en cada intervalo de tiempo
Respuesta Radiográfica
En el Estudio RA-I, se evaluó radiográficamente la inhibición de la progresión del daño estructural y se expresó como el cambio en la Puntuación Total Sharp modificada (mTSS) y sus componentes, la Puntuación de la Erosión (ES) y la puntuación del Pinzamiento del Espacio Articular (JSN), en la Semana 52, comparado con la admisión. CIMZIA inhibió la progresión del daño estructural comparado con placebo más MTX después de 12 meses de tratamiento como se muestra en la Tabla 5. En el grupo placebo, el 52% de los pacientes no experimentó progresión radiográfica (mTSS ≤0,0) en la Semana 52 comparado con el 69% en el grupo de tratamiento con 200 mg de CIMZIA semana por medio. El Estudio RA-II mostró resultados similares en la Semana 24.
| Respuesta | Placebo + MTX N=199 Media (DE) |
CIMZIA 200 mg + MTX N=393 Media (DE) |
CIMZIA 200 mg + MTX - Placebo + MTX Diferencia media |
| mTSS Admisión Semana 24 Semana 52 |
40 (45) 1,3 (3,8) 2,8 (7,8) |
38 (49) 0,2 (3,2) 0,4 (5,7) |
- -1,1 -2,4 |
| Puntuación de Erosión Admisión Semana 24 Semana 52 |
14 (21) 0,7 (2,1) 1,5 (4,3) |
15 (24) 0,0 (1,5) 0,1 (2,5) |
- -0,7 -1,4 |
| Puntuación JSN Admisión Semana 24 Semana 52 |
25 (27) 0,7 (2,4) 1,4 (5,0) |
24 (28) 0,2 (2,5) 0,4 (4,2) |
- -0,5 -1,0 |
Se ajustó un ANCOVA al cambio clasificado desde la admisión para cada medición con la región y el tratamiento como factores y la clasificación en la admisión como una covariable.
Respuesta de la Función Física
En los estudios RA-I, RA-II, RA-III y RA-IV, los pacientes tratados con CIMZIA lograron mayores mejoras desde la admisión que los pacientes tratados con placebo en la función física según lo evaluado por el Cuestionario de Evaluación de Salud – Índice de Incapacidad (HAQ-DI) en la Semana 24 (RA-H, RA-III y RA-IV) y en la Semana 52 (RA-I).POSOLOGIA Y MODO DE ADMINISTRACION:
CIMZIA se administra mediante inyección subcutánea. Los lugares de la inyección deben rotarse y las inyecciones no deben aplicarse en áreas donde la piel es sensible, con tendencia a producir hematomas, enrojecimiento o durezas. Cuando se requiera una dosis de 400 mg (administrada como dos inyecciones subcutáneas de 200 mg), se deben aplicar las inyecciones en lugares diferentes, muslo o abdomen.La solución debe ser inspeccionada visualmente de manera cuidadosa para detectar la presencia de material particulado y decoloración antes de su administración. La solución debe ser un líquido claro incoloro a amarillo, esencialmente libre de partículas y no debe usarse en caso de estar turbia o si existiera material particulado. CIMZIA no contiene conservantes; por lo tanto, se deben descartar las porciones de la droga que quedan en la jeringa.
Enfermedad de Crohn
La dosis en adultos inicial recomendada de CIMZIA es de 400 mg (administrada como dos inyecciones subcutáneas de 200 mg) inicialmente, y en las semanas 2 y 4. En pacientes que obtienen una respuesta clínica, el régimen de mantenimiento recomendado es 400 mg cada cuatro semanas.Artritis Reumatoidea
La dosis recomendada de CIMZIA para pacientes adultos con artritis reumatoidea es de 400 mg (administrada como dos inyecciones subcutáneas de 200 mg) inicialmente (semana 0) y en las semanas 2 y 4, seguida por 200 mg cada 2 semanas (dosis de mantenimiento). Alternativamente, para la dosificación de mantenimiento, se puede considerar 400 mg de CIMZIA cada 4 semanas [ver Estudios Clínicos]. Preparación y Administración de CIMZIA Usando la Jeringa Prellenada Un paciente se puede autoinyectar CIMZIA si un médico determina que es apropiado, con seguimiento médico, en caso de ser necesario, después de la correspondiente capacitación en la técnica de inyección subcutánea. Los pacientes que usan CIMZIA deben ser instruidos para inyectar la cantidad total de la jeringa (1 mL).Monitoreo para Evaluar la Seguridad
Antes de iniciar la terapia con CIMZIA, todos los pacientes deben ser evaluados de infección por tuberculosis tanto activa como inactiva (latente). La posibilidad de tuberculosis latente no detectada debe considerarse en pacientes que han inmigrado o viajado a países con alta prevalencia de tuberculosis y si tuvieron un contacto cercano con una persona con tuberculosis activa. Se deben realizar los correspondientes análisis de detección (por ejemplo, análisis en la piel de tuberculina y radiografía de tórax) en todos los pacientes.Medicamentos Concomitantes
CIMZIA puede ser usado como monoterapia o concomitantemente con drogas antirreumáticas modificadoras de la enfermedad (DMARD) no biológicas. En estudios clínicos de artritis reumatoidea, los pacientes que recibieron terapia con CIMZIA también tomaron metotrexato (MTX) concomitante con la dosis recomendada de CIMZIA de 200 mg semana por medio. CIMZIA no debe utilizarse en combinación con DMARD biológicas u otra terapia con bloqueo del factor de necrosis tumoral (TNF).CONTRAINDICACIONES:
Hipersensibilidad al principio activo o a alguno de los excipientes.Tuberculosis activa u otras infecciones graves como sepsis o infecciones oportunistas.
ADVERTENCIAS y PRECAUCIONES:
Riesgo de Infecciones SeriasSe ha informado infección seria, a veces fatal provocada por patógenos bacterianos, micobacterianos, fúngicos invasivos, virales u otros oportunistas en pacientes que recibieron agentes bloqueantes de TNF. Entre las infecciones oportunistas, las más comunes fueron: tuberculosis, histoplasmosis, aspergillosis, candidiasis; coccidioidomicosis, listeriosis y neumocistosis. Los pacientes frecuentemente han presentado enfermedad diseminada en lugar de localizada, y a menudo toman inmunosupresores concomitantes tales como metotrexato o corticosteroides con CIMZIA.
El tratamiento con CIMZIA no debe iniciarse en pacientes con infección activa, incluyendo infecciones localizadas clínicamente importantes. Los riesgos y beneficios del tratamiento deben considerarse antes de iniciar el tratamiento en pacientes:
- con infección crónica o recurrente
- quienes hayan estado expuestos a tuberculosis
- quienes hayan residido o viajado a zonas de tuberculosis endémica o micosis endémica, tales como histoplasmosis, coccidioidomicosis o blastomicosis
- con condiciones subyacentes que pueden predisponerlos a la infección
El tratamiento de la infección por tuberculosis latente antes de la terapia con agentes bloqueantes de TNF ha demostrado reducir el riesgo de reactivación de la tuberculosis durante la terapia. La induración de 5 mm o mayor con análisis de piel de tuberculina debe considerarse un resultado de análisis positivo cuando se evalúa si se requiere tratamiento para tuberculosis latente antes de iniciar el tratamiento con CIMZIA, aún para pacientes previamente vacunados con Bacillo Calmette-Guerin (BCG).
La terapia antituberculosis también debe considerarse previo a la iniciación de CIMZIA en pacientes con antecedentes de tuberculosis latente o activa en los cuales no se puede confirmar un adecuado curso del tratamiento, y para pacientes con un análisis negativo para tuberculosis latente pero que tienen factores de riesgo para la infección de tuberculosis. Se recomienda la consulta con un médico especializado en el tratamiento de la tuberculosis para ayudar en la decisión de si es apropiado iniciar una terapia antituberculosis en el paciente.
La tuberculosis debe ser fuertemente considerada en pacientes que desarrollan una nueva infección durante el tratamiento con CIMZIA, especialmente en pacientes que han viajado previa o recientemente a países con una alta prevalencia de tuberculosis, o quienes han tenido un contacto cercano con una persona con tuberculosis activa.
Los pacientes deben ser controlados cuidadosamente por el desarrollo de signos y